Single Page
Inhalt
- Aktuelles PSE
- mit Molekülionen
- ohne Molekülionen
- Kurz-PSE
- Fünfbindiger Stickstoff vs. Oktettregel?
- Schreibweisen im Kräftemodell und Elektronenmodell
- PSE ohne „5 über N“ mit Molekülionen
- PSE ohne „5 über N“ ohne Molekülionen
- Anmerkungen
- Atomradien
- Konzept
- Begleitmaterial
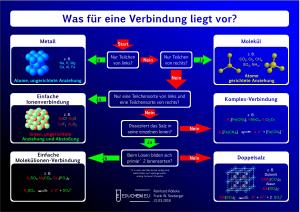
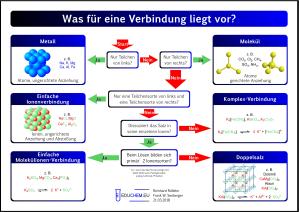
- Entscheidungsschema
- Literatur
- Chemie für Quereinsteiger
- Historie PSE Didaktik
Über das Didaktik-PSE
Herr Weiner: „Das Periodensystem der Grundbausteine und Kräfte“, Erklärvideo auf YouTube, 17:14 Minuten, 05.07.2021; letzter Abruf Dezember 2022.
https://www.youtube.com/watch?v=iATC7KsHFic
Hans‐Dieter Barke: Bindigkeit und Elektronenpaar – zwei Bindungsmodelle für den Chemieunterricht.
Chemkon, Volume 28, Issue 8, December 2021.
Matthias Kremer, Ulrich Bee: Einsatzmöglichkeiten der didaktisch aufbereiteten Periodensysteme „Periodensystem der Grundbausteine und Kräfte“ und „Periodensystem der Elemente in drei Ebenen PSE³“.
Chemkon, Volume 26, Issue 7, Pages 286-293, October 2019.
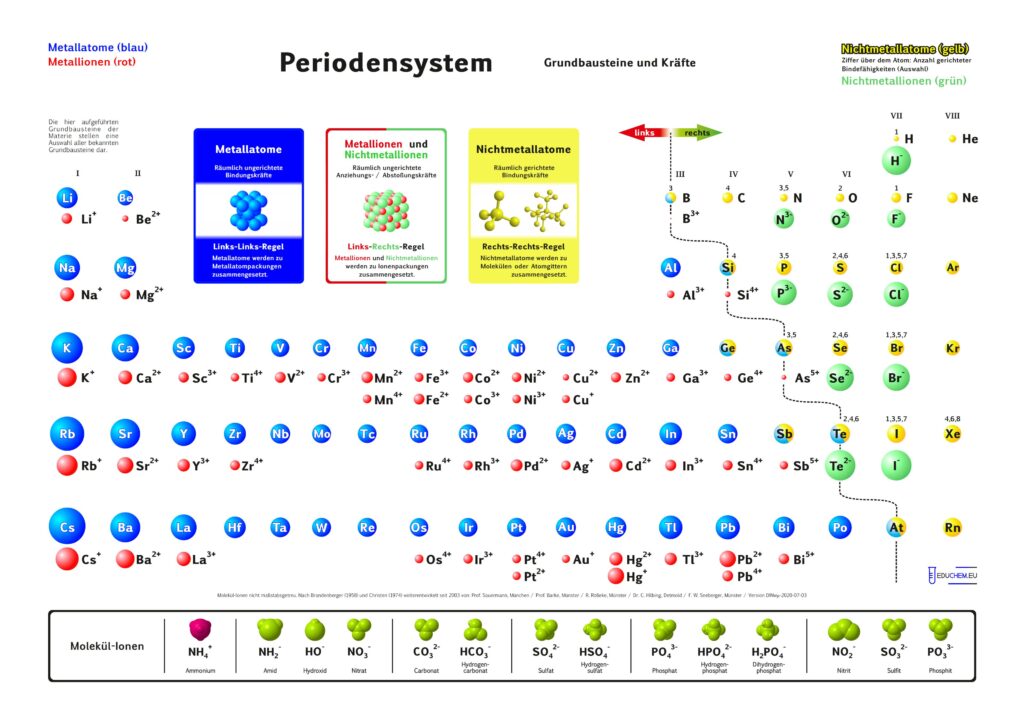
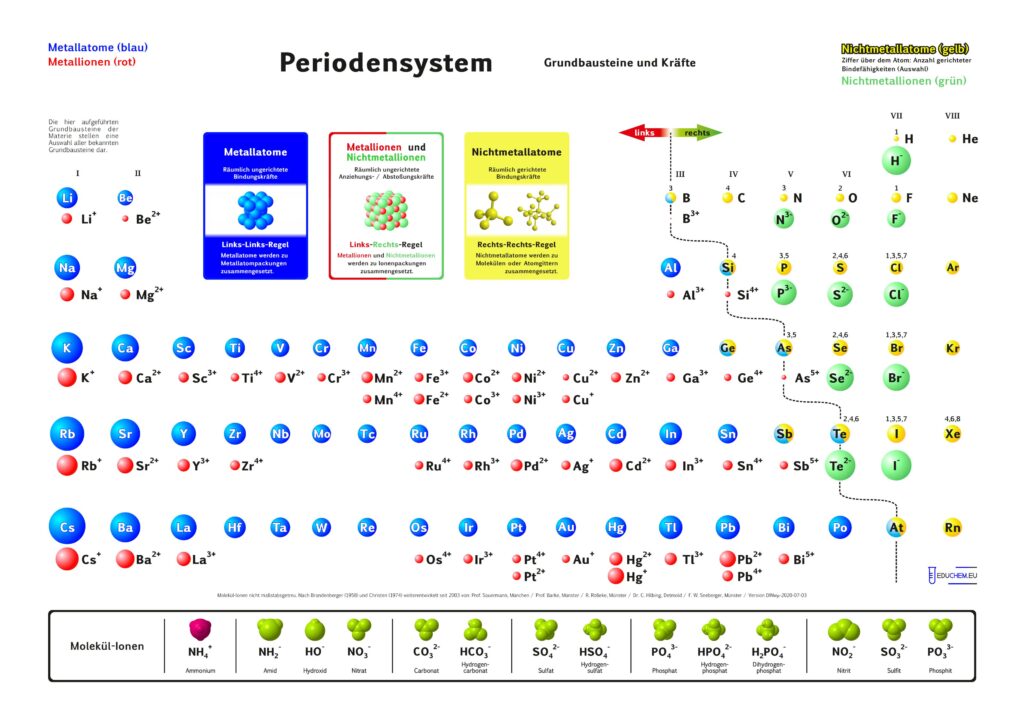
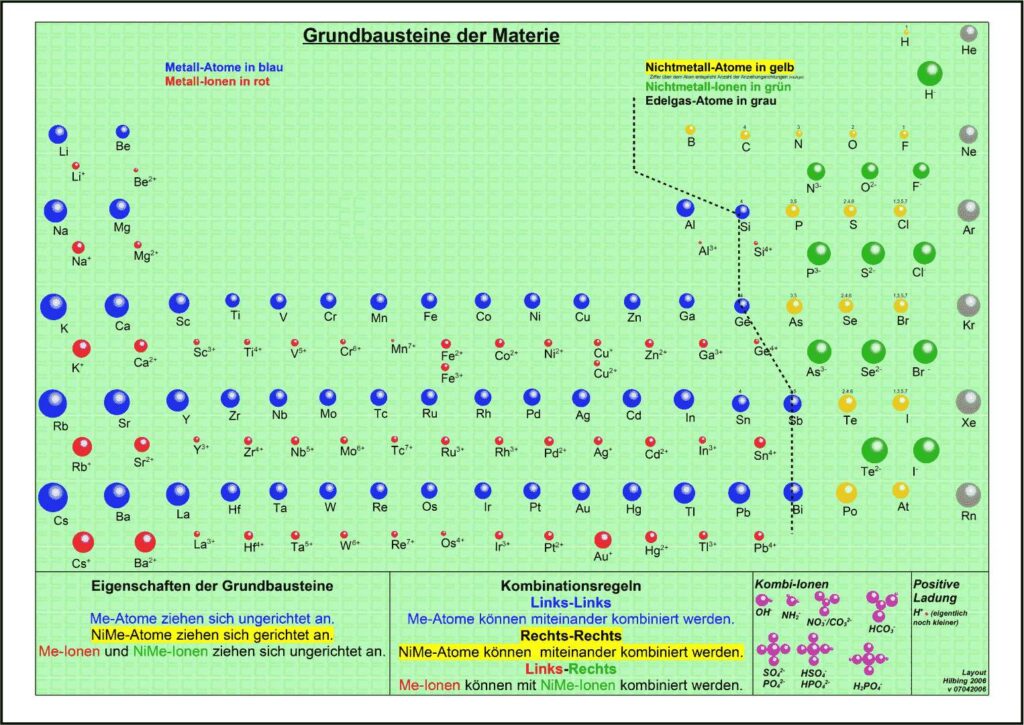
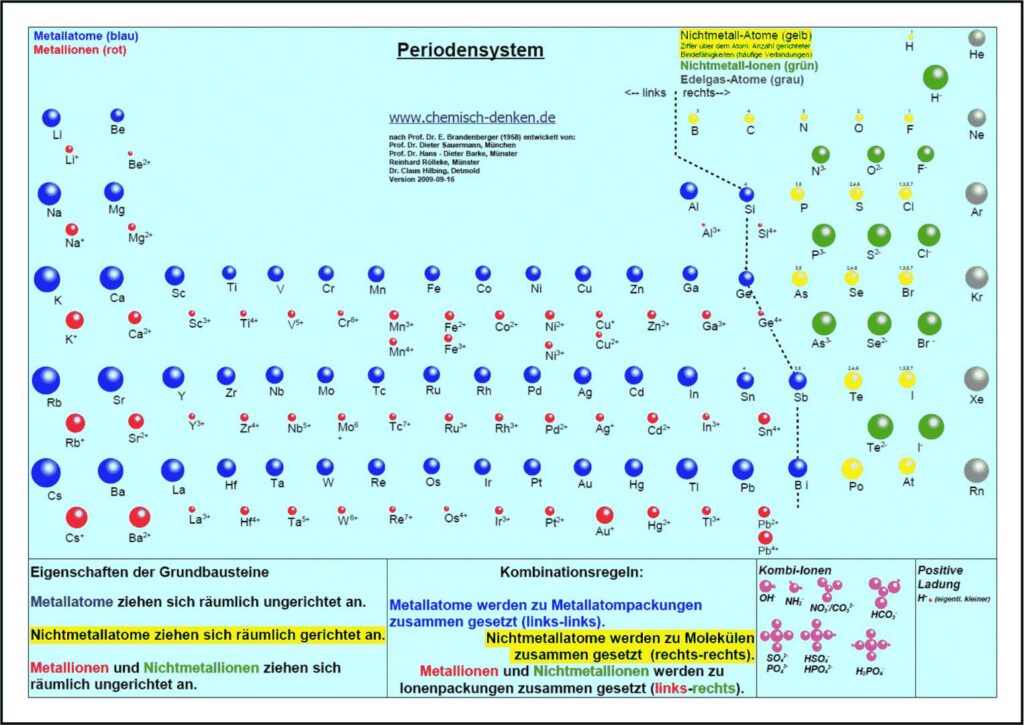
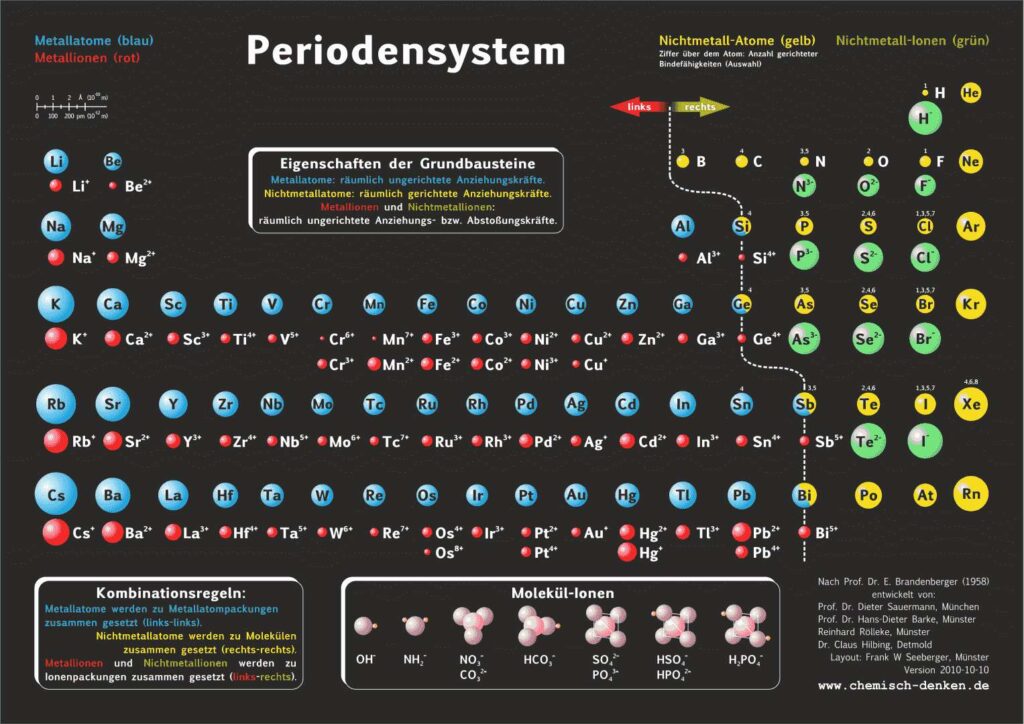
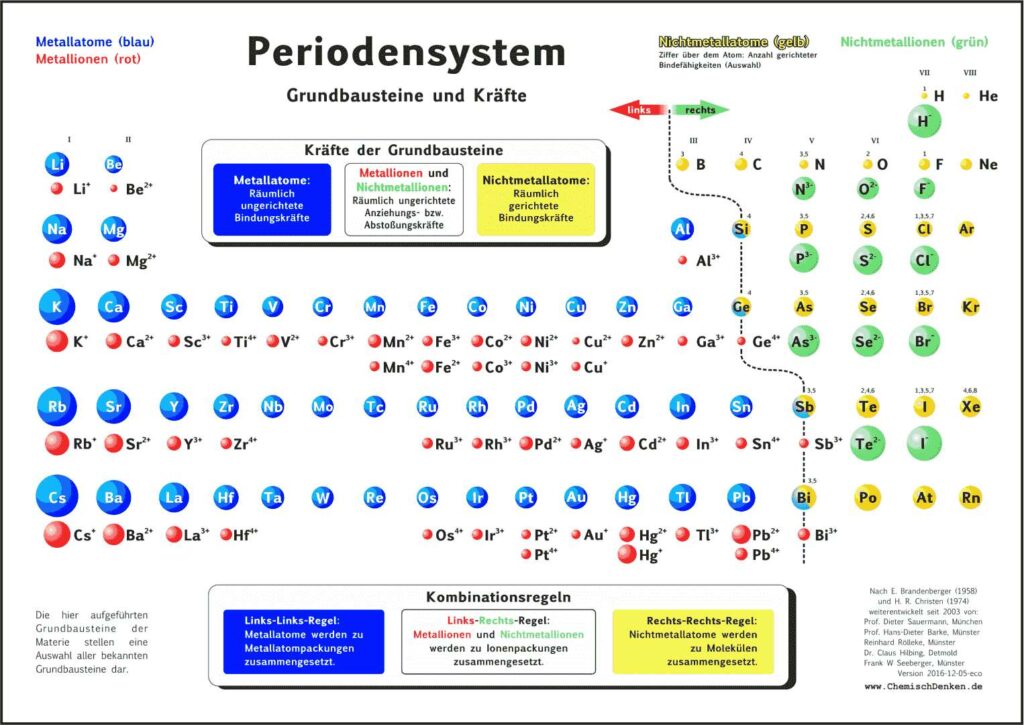
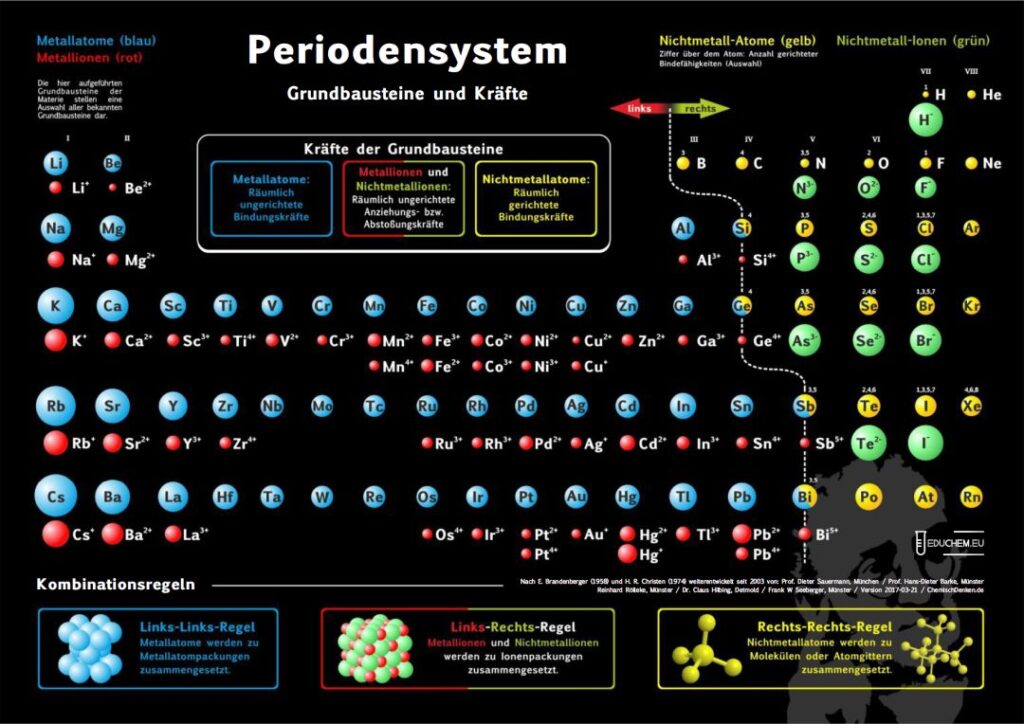
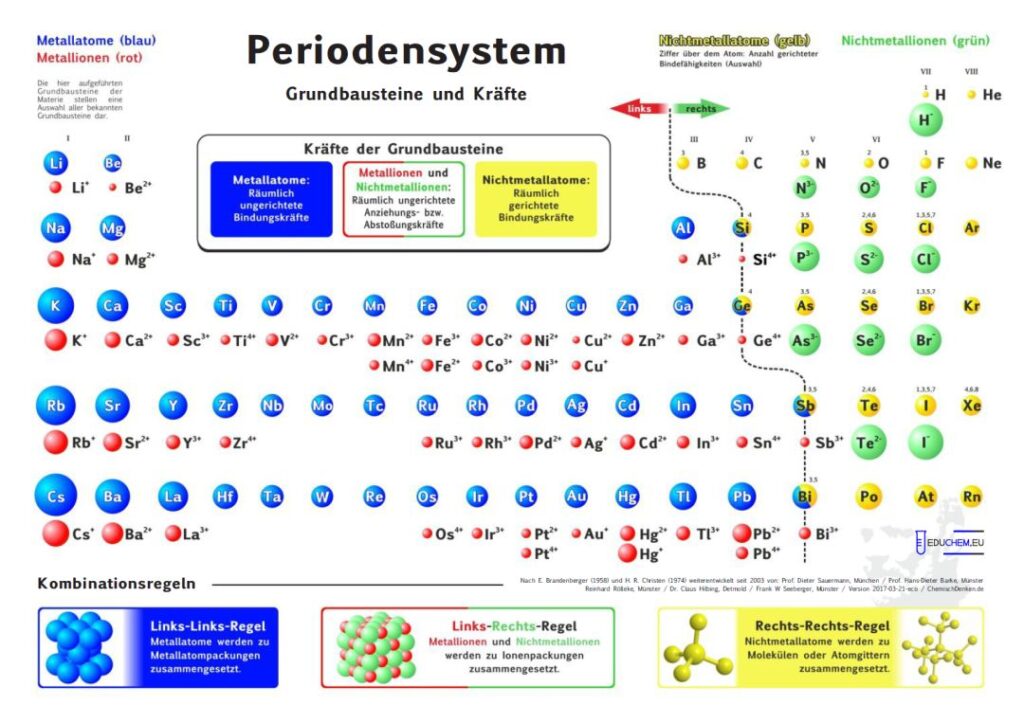
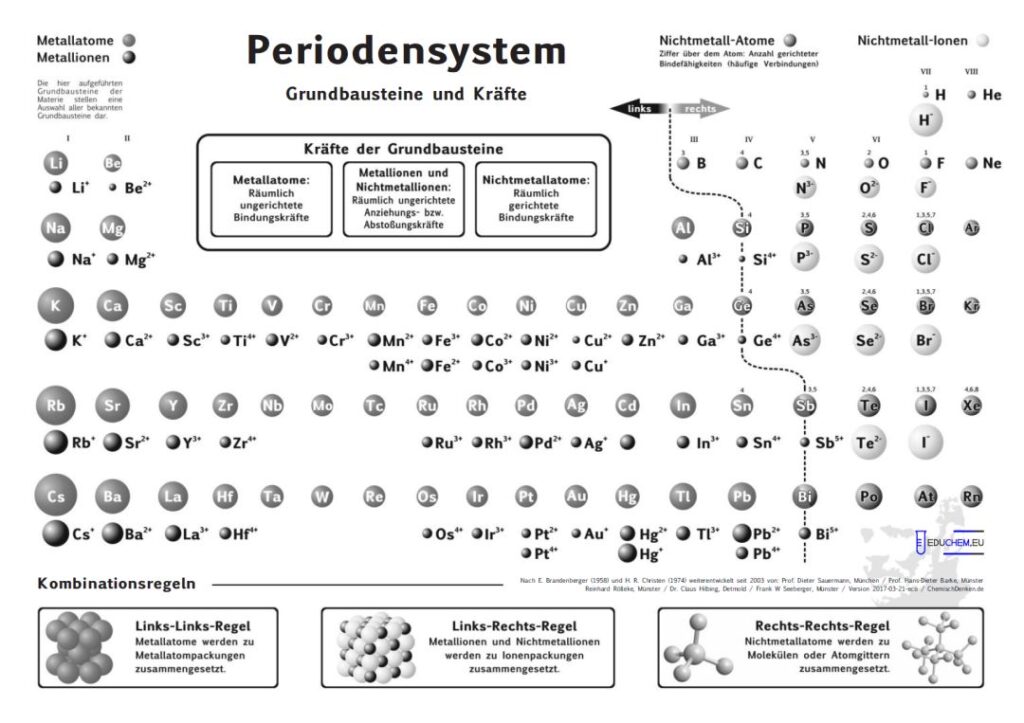
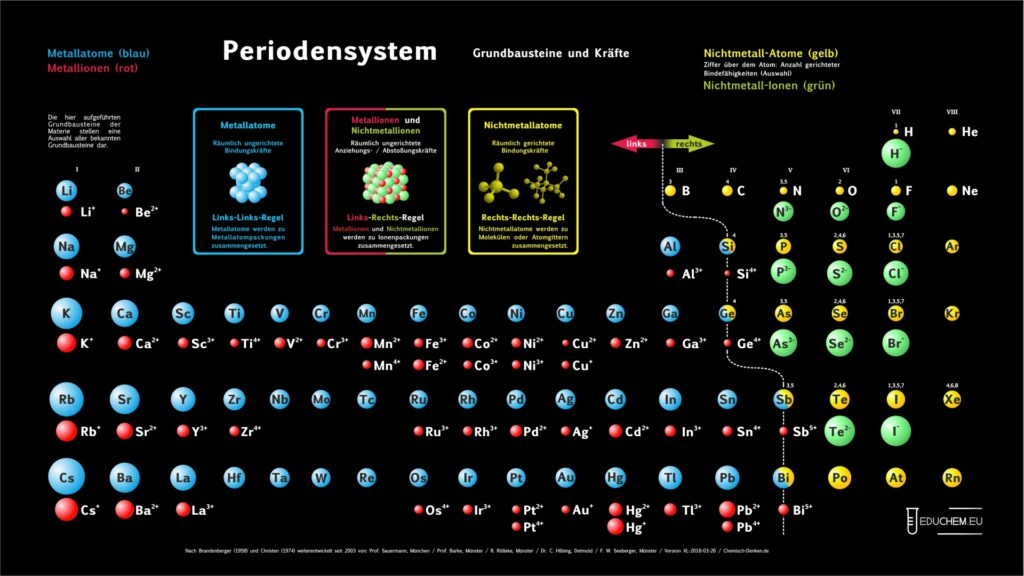
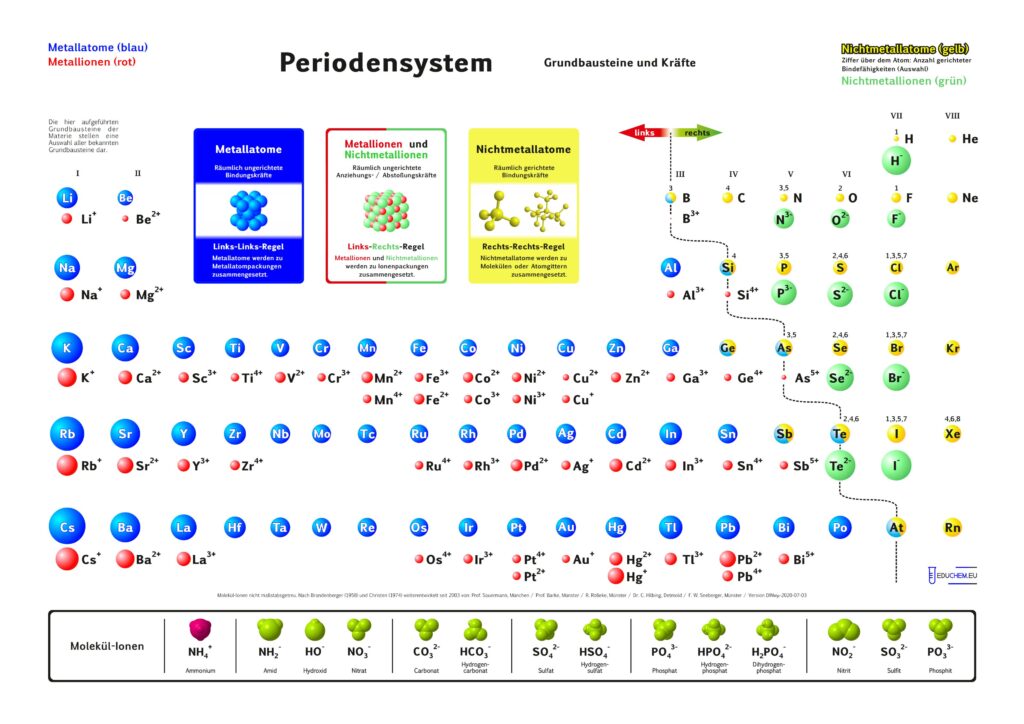
1. Aktuelles Periodensystem
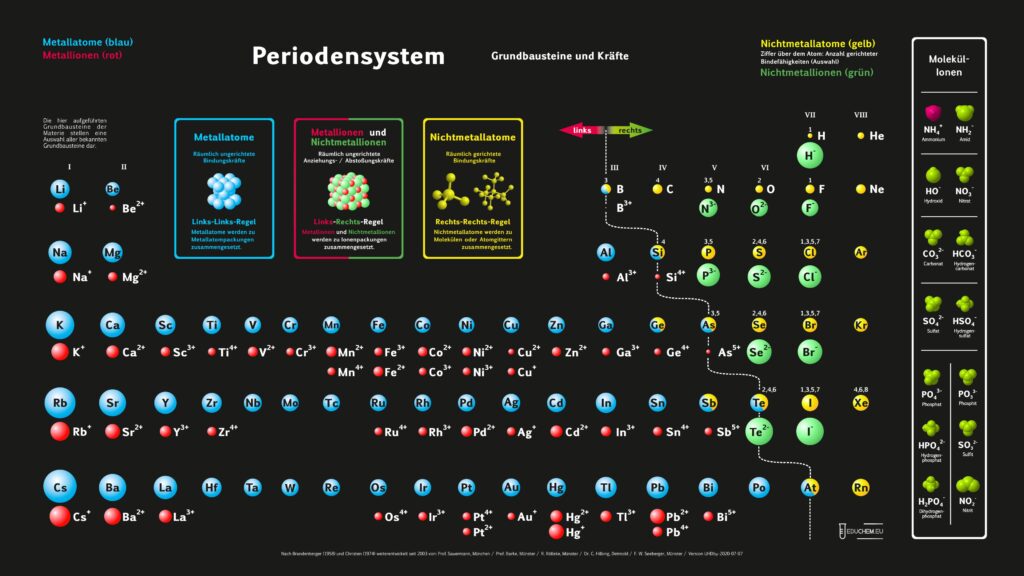
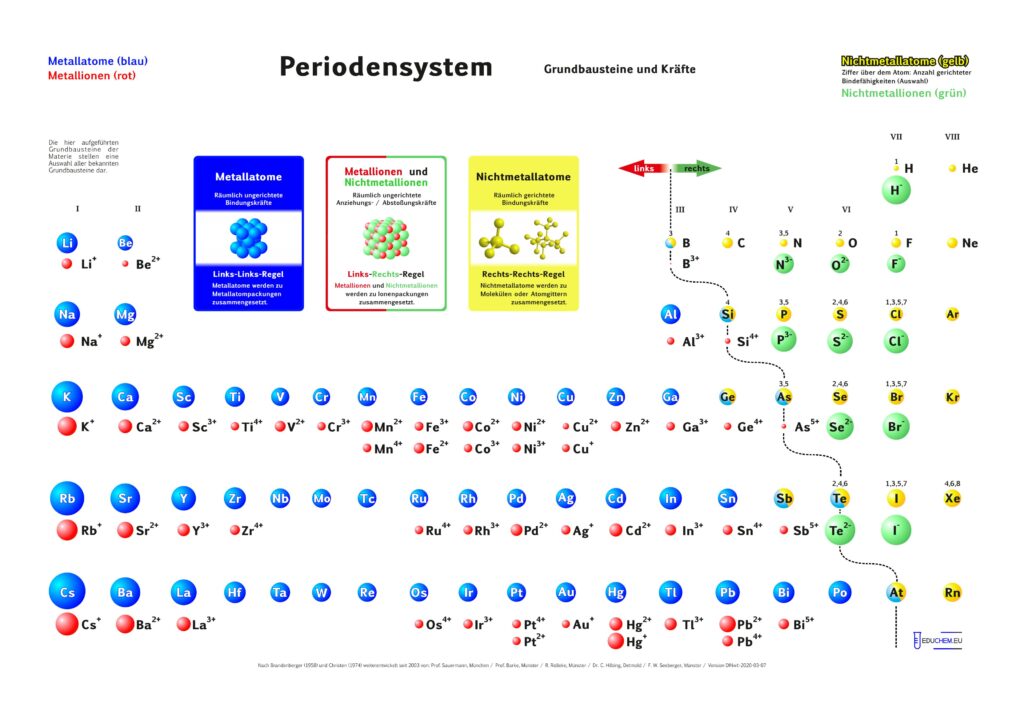
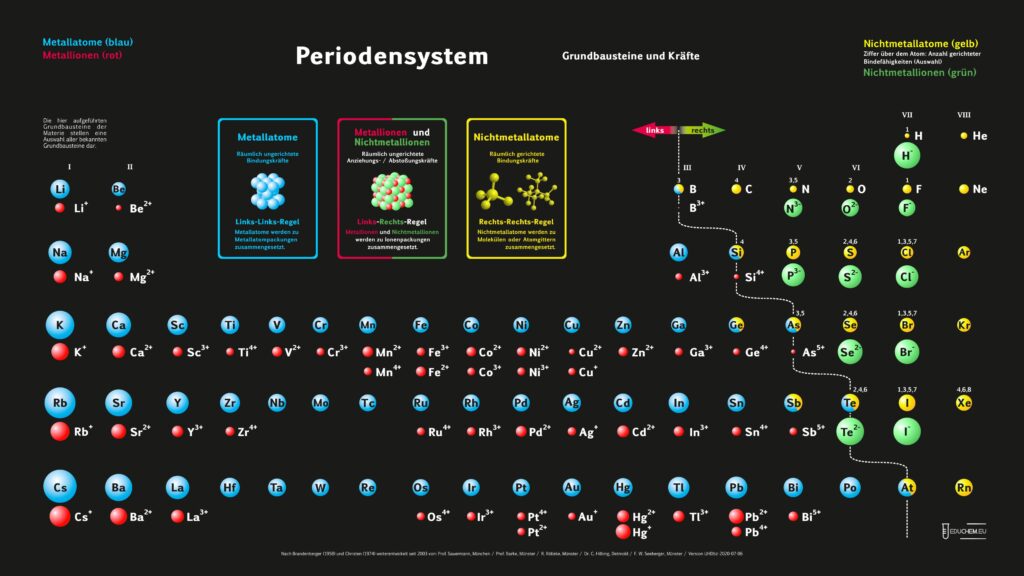
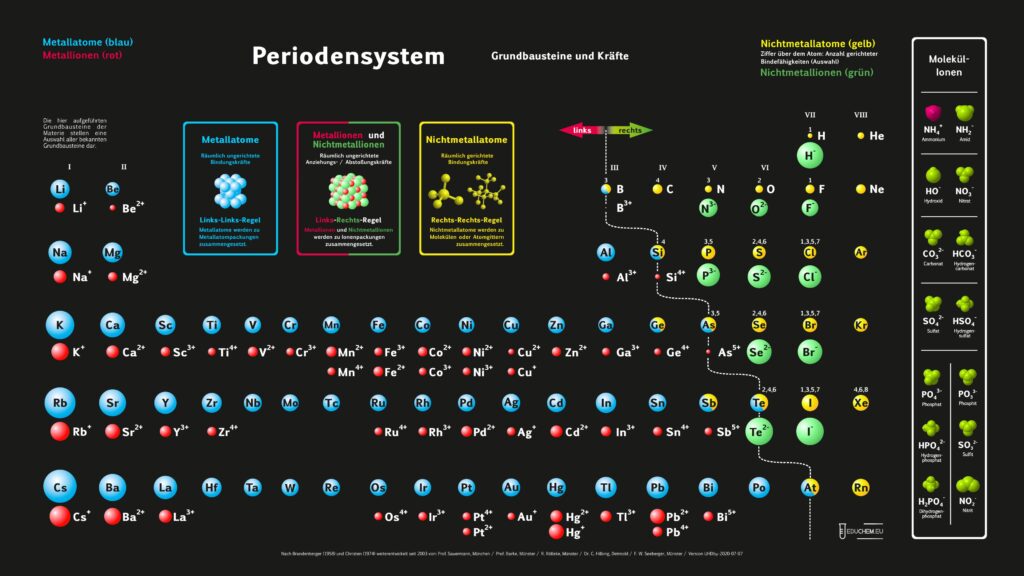
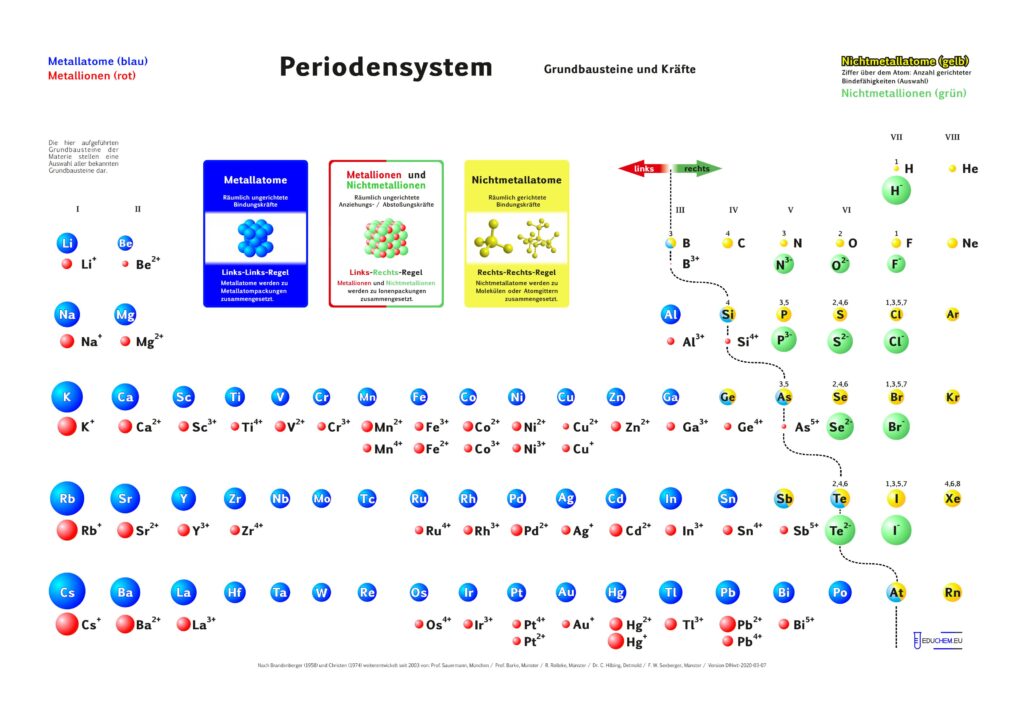
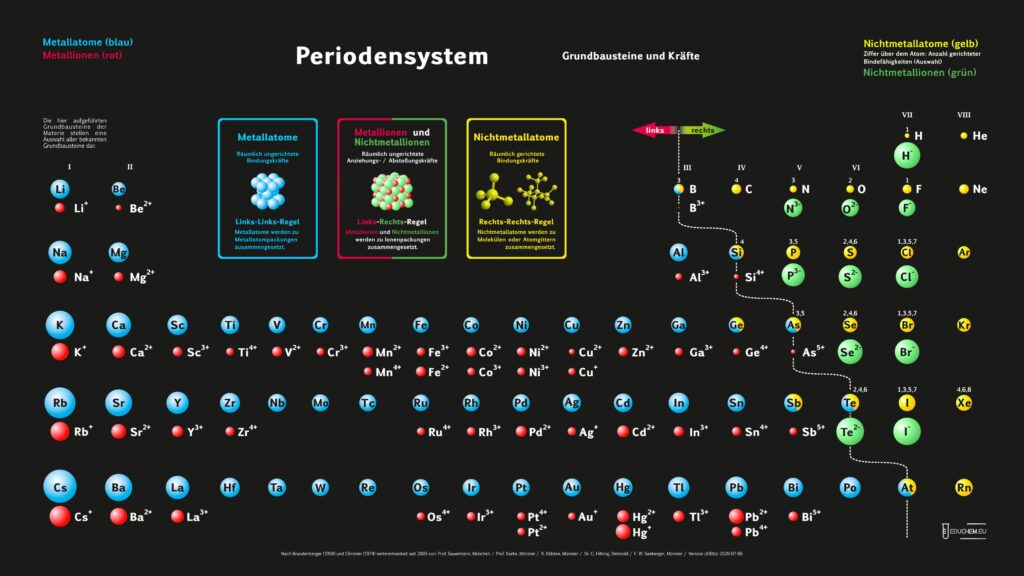
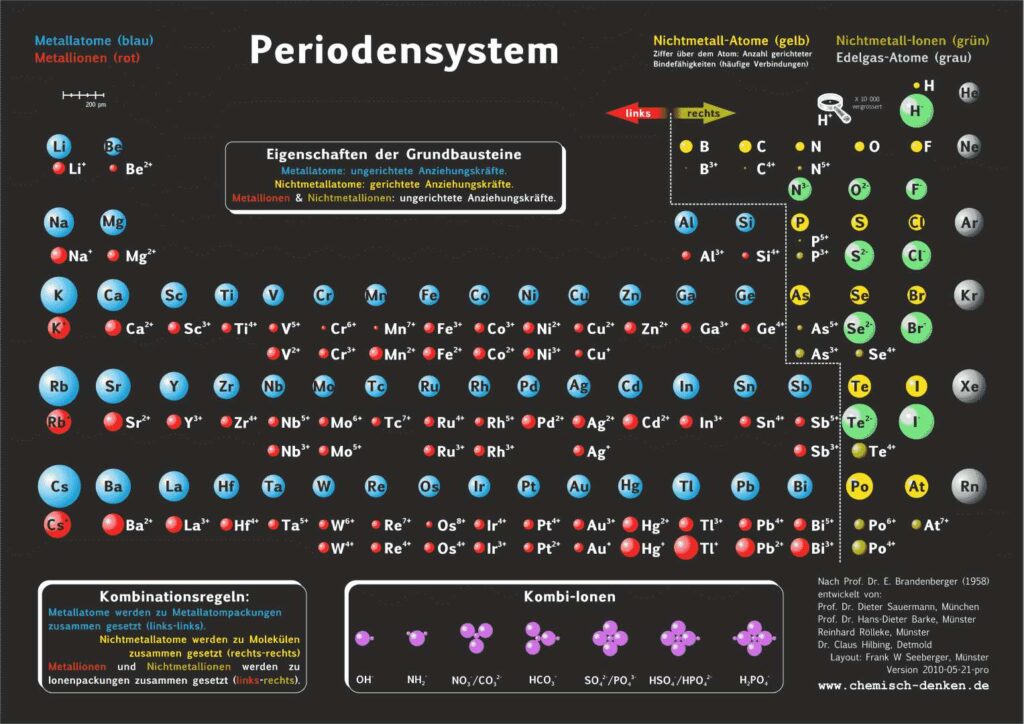
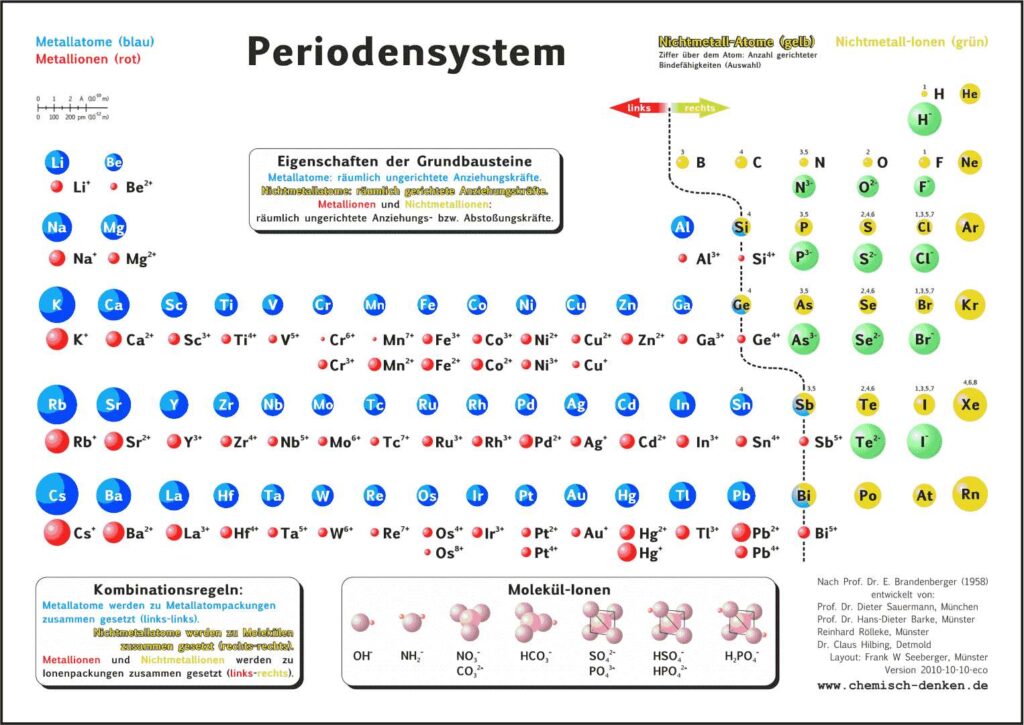
Es gibt verschiedene Varianten: Neben einer ohne Molekülionen gibt es DIN-Versionen, die sich besonders für den A4-Druck empfehlen. Die HD-Varianten (in schwarz) sind zur bildschirmfüllenden Darstellung oder auch für den Posterdruck. Es gibt auch eine Version in englischer Sprache.
Didaktik PSE mit Molekül-Ionen
Didaktik PSE ohne Molekül-Ionen
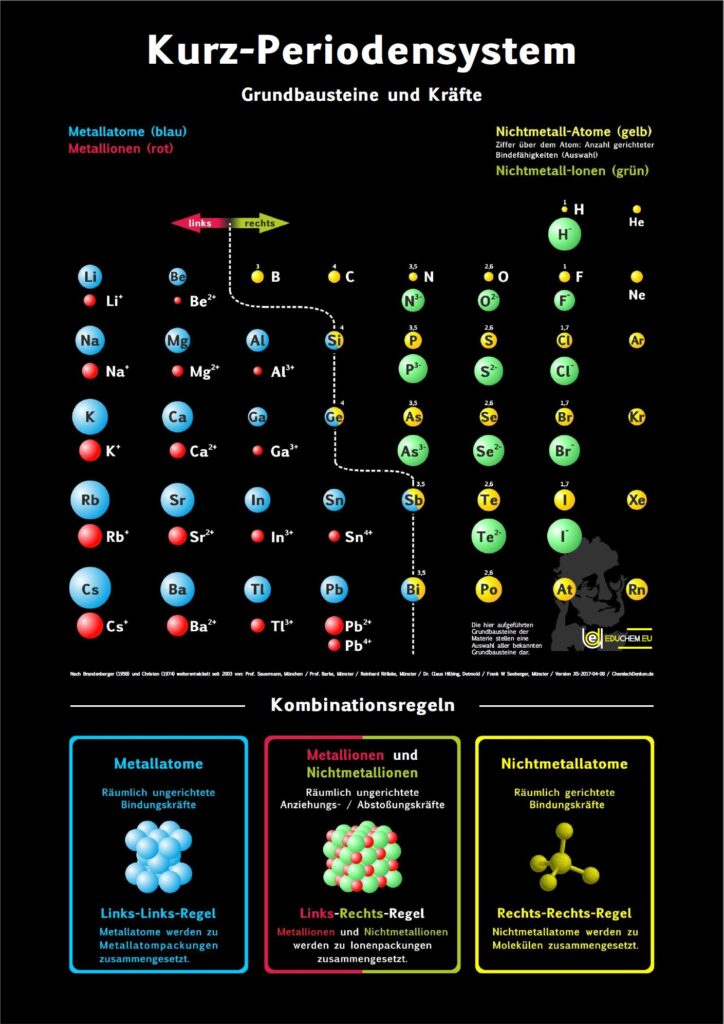
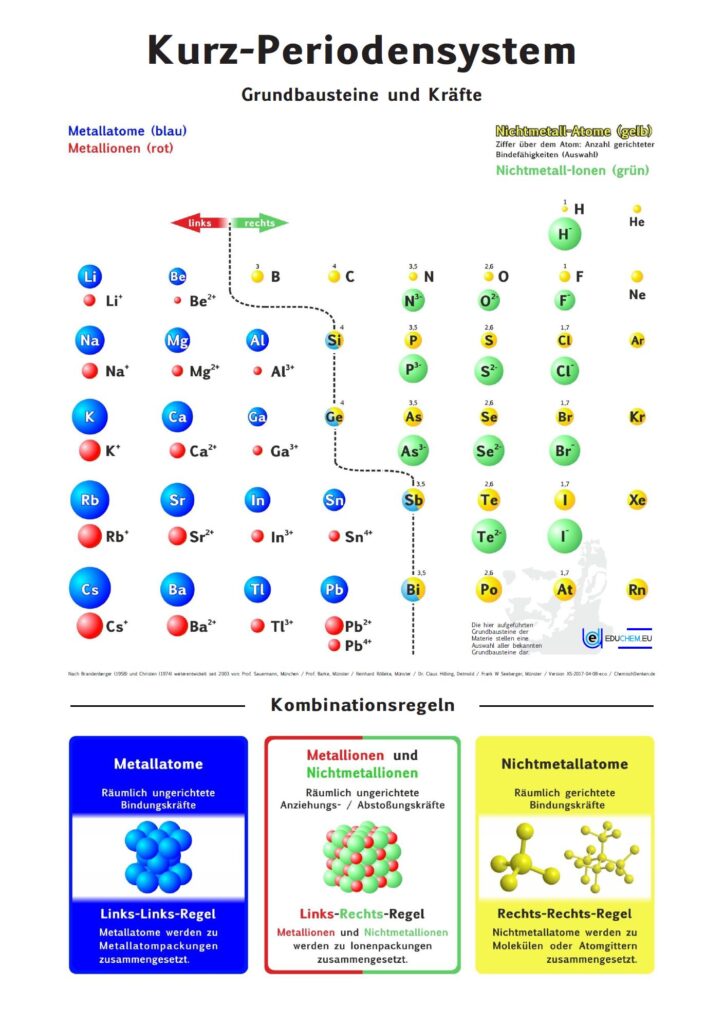
Kurz-PSE Didaktik
Das didaktische Periodensystem als Kurz-PSE (repräsentatives Periodensystem).
2. Fünfbindiger Stickstoff?
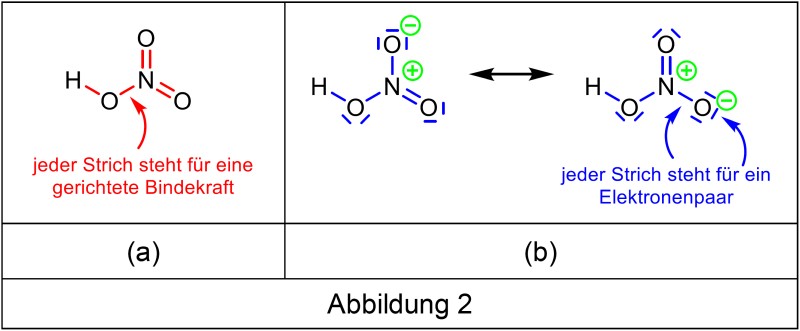
Die „5“ über dem Stickstoff sorgt gelegentlich für Irritationen. Es ist kein Verstoss gegen die Oktettregel, weil es bei der Oktettregel um die Erlangung eines Elektronenoktetts geht. Das PSE verwendet aber ein Kräftemodell: Jeder Bindestrich steht hier für eine gerichtete Bindekraft (Abb. 1a), nicht für ein Elektronenpaar (Abb. 1b). Allerdings ist die Darstellung nicht von der gewohnten Elektronenschreibweise zu unterscheiden, vor allem, wenn die freien Elektronenpaare – wie so oft – weggelassen werden (Abb. 1c).
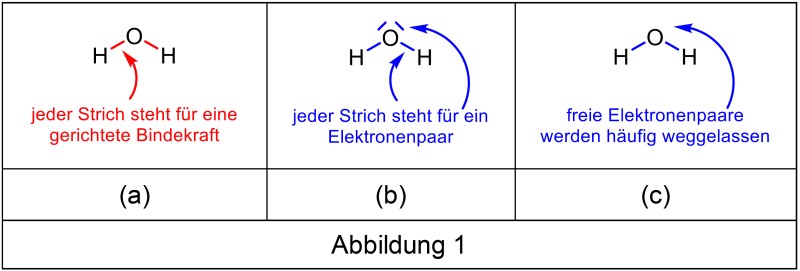
Bei der Formel für Wasser ist das weniger auffällig, anders bei der Salpetersäure. Die Elektronenschreibweise verlangt die Verwendung von mesomeren Grenzformeln (Abb. 2b), wenn die Oktettregel erfüllt sein soll. In der Kräfteschreibweise wird die Formel mit 5 gerichteten Bindekräften dargestellt (Abb. 2a).
Für alle, die das Periodensystem – Grundbausteine und Kräfte ohne 5-bindigen Stickstoff bevorzugen, gibt es hier die PSE-Varianten, bei denen Stickstoff ausschließlich 3 gerichtete Bindefähigkeiten zugeordnet sind (ohne „5 über N“):
Didaktik PSE mit Molekül-Ionen
Didaktik PSE ohne Molekül-Ionen
3. Anmerkungen
Atomradien
Einleitung
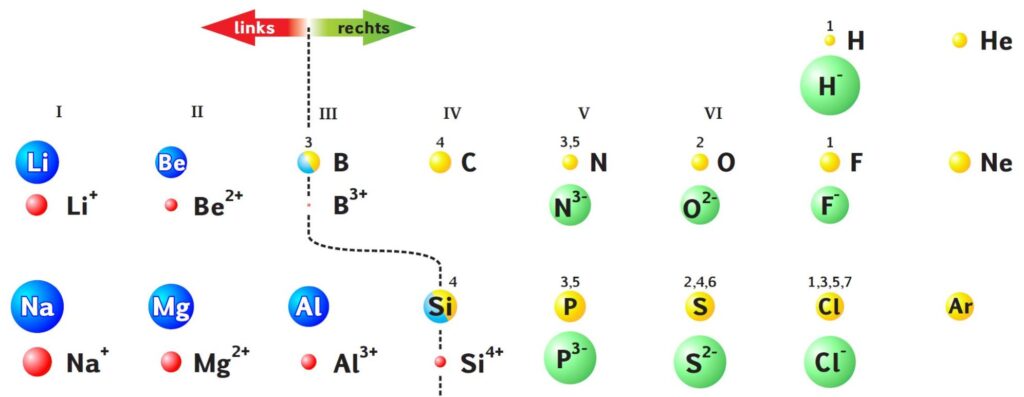
Die Atomradien nehmen innerhalb einer Periode der Hauptgruppenelemente mit steigender Ordnungszahl ab (Owen, Brooker). Vergleicht man die Atomradien der Edelgase mit dem jeweils links davon liegenden Halogen (bzw. Wasserstoff), ergeben sich Unregelmäßigkeiten in den ersten Perioden. So ist He deutlich größer als H (40 %), Ne etwas größer als F (7 %), Cl und Ar gleich groß. Ab der 4. Periode folgen die Radien dem anfangs genannten Trend. So ist Kr etwas kleiner als Br (5 %) und Xe kleiner als I (5 %).

Warum die Radien innerhalb der Periode kleiner werden
Elektronen können sich gegenseitig abschirmen, wobei die äußeren Elektronen eine Abschirmung durch andere (v. a. innere) Elektronen erfahren. Innerhalb der Periode kommt jeweils ein Proton und ein Elektron hinzukommt (Neutronen werden wegen Ladungsneutralität hier vernachlässigt). Die neu hinzu gekommenen Elektronen auf den gleichen Schalen schirmen sich jedoch gegenseitig nur gering ab, do daß durch jedes neu hinzu kommende Proton die effektive Kernladung von Element zu Element steigt: Die Elektronen werden stärker angezogen und die Radien schrumpfen periodenweise.
Beispiel: Innerhalb Periode 2 ist das Li-Atom groß (152 pm), weil das äußere Elektron durch die innere (1s-) Schale abgeschirmt ist und daher nicht so stark vom Kern angezogen wird. Be ist klein (111 pm), weil das 2. Außenelektron vom 1. Außenelektron nur sehr viel schwächer abgeschirmt wird, die effektive Kernladung steigt und die Außenelektronen werden stärker vom Kern angezogen.
Warum Heliumatome deutlich größer sind als Wasserstoffatome
Elektronen stossen sich aufgrund gleicher Ladung untereinander ab. Das Atom des Wasserstoffs, das kleinste unter den Elementen überhaupt, besteht lediglich aus einem Proton und einem Elektron. Geht man nun zu Helium über, so kommt ein Proton und ein weiteres Elektron hinzu. Da das Wasserstoff-Atom aber so winzig ist, sind die Abstoßungskräfte beim Hinzufügen eines zweiten Elektrons auf die kleine s-Schale erheblich. Beide Elektronen befinden sich auf der gleichen, ersten Schale, d. h. es gibt keine innere Schale. Der oben beschriebene Effekt, der die Periodizität verursacht, kann nicht eintreten. Stattdessen überwiegen die Abstoßungskräfte und das Helium-Atom ist letztlich größer als das des Wasserstoffs.
Die deutliche Abstoßung der beiden Elektronen in der ersten s-Schale kann man sich vor Augen führen, wenn man das Hydrid-Ion H– betrachtet. Es besteht nur aus einem Proton und zwei Elektronen (somit einem Proton weniger als das Helium-Atom), aber ist größer als das Bromid-Anion sowie Calcium-Atom und beinahe so groß wie das Kalium-Atom oder das riesige Iodid-Anion aus der fünften Periode.
Bei Neon ist dieser Abstoßungs-Effekt schon deutlich geringer (7 % größer als F, bei Argon noch geringer (gleiche Größe wie Chlor). Ab Krypton besteht, wie eingangs erwähnt, die zu erwartende Periodizität (Br > Kr, I > Xe), die für die ersten sieben Hauptgruppen schon ab der 2. Periode Gültigkeit hat.
Fazit
Die Atomradien werden innerhalb einer Periode der Hauptgruppenelemente von links nach rechts kleiner, weil hinzukommende Elektronen in der Außenschale von den dort vorhandenen nur schwach abgeschirmt werden und somit näher an den Kern herangezogen werden (steigende effektive Kernladung). Die Ausnahmen bei den Edelgasen kommen durch elektrostatische Abstoßungseffekte der Elektronen in der vollbesetzten Außenschale zustande, bei kleineren Atomen mehr als bei Größeren.
Quellen
S. M. Owen, A. T. Brooker, Konzepte der Anorganischen Chemie, Seite 2f
Vieweg, 1994; ISBN-10: 3528065591, ISBN-13: 978-3528065591
Quelle für die Atom- und Ionenradien im didaktischen PSE waren die Angaben in:
Fluck, Heumann, Periodensystem der Elemente, Wiley-VCH, 2002
ISBN-10: 3527307168, ISBN-13: 978-3527307166
Für die Edelgase sind dort nur die Van-der-Waals-Radien angegeben. Daher werden für den Vergleich im obigen Text genau genommen nicht Atomradien, sondern Van-der-Waals-Radien verglichen. Für Atomradien finden sich tatsächlich nach P. Ramdohr / H. Strunz (Lehrbuch der Mineralogie, Enke, Stuttgart, 1978) für alle Edelgase Radien, die die der davorliegenden Halogene deutlich überragen. Bis zur 3. Periode wird auch die Größe der Alkalimetalle übertroffen, und in der 2. Periode gibt es weitere Unregelmäßigkeiten (Minimum bei N): N < F < O < Ne.
4. Konzept
Das PSE als Teilchenbaukasten

4.1. Grundbausteine
Untersucht man viele Substanzen experimentell bezüglich ihrer Bausteine, dann erhält man zwei, in ihren Qualitäten unterschiedliche Arten kleinster Teilchen. Ein großer Teil der Teilchen reagiert im elektrischen Feld, sie besitzen elektrische Ladung. Sie werden als Ionen bezeichnet. Andere Teilchen reagieren im elektrischen Feld nicht,
sie sind elektrisch ungeladen und heißen Atome. Die Teilchen werden als kugelförmige Grundbausteine dargestellt.
4.2. Kräfte
Viele Atome besitzen Kraftwirkungen untereinander, z. B. ziehen sich Eisenatome gegenseitig so stark an, dass Eisen zu den harten Substanzen gehört. Ionen üben andersartige Kraftwirkungen aufeinander aus, es gibt Anziehungs- und Abstoßungskräfte zwischen Ionen.
Dazu mehr in Barke, Sauermann, Chemie für Quereinsteiger – Band 1, Seite 26, http://www.wikichemie.de/web/band1_3.php
Aufgrund einer experimentellen Prüfung der Kraftqualitäten von Teilchen empfiehlt sich eine Einteilung in drei Klassen:
- Metall-Atome
- Nichtmetall-Atome
- Ionen
Die Einteilung erfolgt also aufgrund der Kraftqualität gegenüber anderen Teilchen. Dies ist die Grundlage unseres Unterrichtskonzepts.
4.3. Kombination der Grundbausteine
Alle Substanzen werden als – wie aus Legosteinen – zusammen gesetzte Kombinationen unzählig vieler Atome oder Ionen zu einem Teilchenverband beschrieben. Für das Konzept soll gelten: Es lassen sich sich nur Teilchen mit gleicher Kraftqualität zu Substanzen zusammen setzen. Die Verknüpfung von Teilchen erfolgt nach drei Regeln:
- Wenn wir im linken Teil des Periodensystems Teilchen miteinander verbinden wollen, dann müssen wir die Atome wählen und räumlich ungerichtet verknüpfen.
- Bei Teilchen aus dem rechten Teil wählen wir die Atome und verknüpfen sie räumlich gerichtet.
- Die Kombination von Teilchen der linken Seite mit Teilchen der rechten Seite verlangt, die entsprechenden Ionen räumlich ungerichtet zu verknüpfen.
Mehr dazu in Barke, Sauermann, Chemie für Quereinsteiger – Band 1, Seite 50. http://www.wikichemie.de/web/band1_4.php
Das PSE als Kombinationsbaukasten
Eine Erklärung des Periodensystems finden Sie in Barke, Sauermann, Chemie für Quereinsteiger – Band 1, Seite 22. http://www.wikichemie.de/web/band1_2.php
Weitere Hinweise
Die Anordnung des klassischen elektronentheoretisch begründeten Periodensystems wird von uns übernommen. Die Kräfte und Kombinationsregeln wurden eingetragen. Es liegt den Klassen im Unterricht sowie in allen Tests und Klausuren vor. Es werden
gute Lernerfolge erzielt im Verständnis von Strukturen und im Aufstellen und Erklären von Formeln und Gleichungen sowie bei der Symbolisierung von chemisch gedachten Strukturen und deren Veränderungen.
Anmerkung zur Stellung des Wasserstoffs
Die 7. Hauptgruppe beginnt mit dem Element Wasserstoff. Andere Darstellungen ordnen ihn in der 1. Hauptgruppe ein. Er wird hinsichtlich des Grundbaustein-Konzeptes wegen folgender Familienähnlichkeiten hier eingeordnet:
- Er bildet als Grundbaustein für Substanzen das H-Anion, das Kation (Proton) kann dagegen kein Gitterbaustein sein.
- Seine Ionenpackungen werden analog zu denen der Halogene gebildet, indem das negative H-Ion für links-rechts-Kombinationen den Gitterbaustein darstellt.
- Er ist wie die Halogene ein Nichtmetall und bildet viele zu den Halogenen analoge Nichtmetallverbindungen (rechts-rechts-Kombination).
Dies ist eine chemisch und didaktisch begründete Entscheidung. Sie geht von dem Ziel aus, die Grundbausteine zu repräsentieren und ein System vorzustellen, mit dem Verknüpfungen von Grundbausteinen richtig erstellt werden können. Dabei ist es absolut notwendig, dass der Wasserstoff so positioniert wird, weil sich das System sonst selbst
widerspricht. Die Einordnung des Wasserstoffs bei den Alkalimetallen soll weder bekämpft noch kritisiert werden – denn sie ist nicht besser oder schlechter, sondern sie ist ebenfalls eine zweckgebundene sachliche und didaktische Entscheidung – wie die unsere auch. Viel Erfolg mit beiden Systemen im Unterricht!
Text: Reinhard Rölleke, 2010
früher auf chemisch-denken.de
5. Begleitmaterial
Um sich mit der Idee hinter dem Didaktischem Periodensystem vertraut zu machen, empfiehlt es sich, mit dem Konzept zu beginnen. Die HTML-Version war früher bei Chemisch-Denken.de zu lesen.
Herr Weiner hat (unabhängig von den Autoren) auf YouTube ein Erklärvideo zum Didaktischen PSE veröffentlicht.

2018-03-24
(Text: 2010)
Herr Weiner: „Das Periodensystem der Grundbausteine und Kräfte“, Erklärvideo auf YouTube, 17:14 Minuten, 05.07.2021; letzter Abruf Dezember 2022.
https://www.youtube.com/watch?v=iATC7KsHFic
Der Artikel Strehle, Rölleke, Barke: „Das Ion im Chemieunterricht – noch Vorstellungen von gestern?“ aus der MNU 60/6 beschreibt den Einsatz des Periodensystems im Chemie-Unterricht.
Eine frühe Version des Periodensystems wurde in der Veröffentlichung Sauermann, Barke: Chemie für Quereinsteiger – Band 1 (1997) eingeführt, dort werden die Grundlagen dazu erläutert. Download bei WikiChemie.de
Literatur
Hans‐Dieter Barke: Bindigkeit und Elektronenpaar – zwei Bindungsmodelle für den Chemieunterricht.
Chemkon, Volume 28, Issue 8, December 2021.
Matthias Kremer, Ulrich Bee: Einsatzmöglichkeiten der didaktisch aufbereiteten Periodensysteme „Periodensystem der Grundbausteine und Kräfte“ und „Periodensystem der Elemente in drei Ebenen PSE³“.
Chemkon, Volume 26, Issue 7, Pages 286-293, October 2019.
Tobias Dörfler, Hans-Dieter Barke: Das an Schülervorstellungen orientierte Unterrichtsverfahren: Beispiel Neutralisation.
Chemkon, Volume 16, Issue 3, Pages 141-146, July 2009.
Hans-Dieter Barke, Christian Pieper: Der Ionenbegriff – historischer Spätzünder und gegenwärtiger Außenseiter.
Chemkon, Volume 15, Issue 3, Pages 119-124, July 2009.
Nina Strehle, Reinhard Rölleke, Hans-Dieter Barke: Das Ion im Chemieunterricht – noch Vorstellungen von gestern?
MNU, Volume 60, Issue 6, Pages 366-371, 1.9.2007.
Claus Hilbing, Hans-Dieter Barke: Fehlvorstellungen hausgemacht! Ergebnisse empirischer Erhebungen und unterrichtliche Konsequenzen.
Chemkon, Volume 11, Issue 3, Pages 115-120, July 2004.
6. Chemie für Quereinsteiger
In jedem Lexikon steht zu lesen: „Die Chemie ist die Lehre von den Eigenschaften der Substanzen und deren Umwandlungen.“ Der in diese Lehre Nichteingeweihte hört davon mit Schaudern, in neuerer Zeit sogar immer mehr mit Ablehnung. In den Schulen steht das Fach Chemie an nahezu letzter Stelle der Beliebtheitsskala, es wird für schwierig und undurchschaubar gehalten.
Woran liegt es wohl, daß Schüler der Sekundarstufe Chemie als ein Horrorfach empfinden? Welches sind die Gründe dafür, daß Studenten des Maschinenbaues, der Elektrotechnik oder des Bauingenieurwesens womöglich am Fach Chemie scheitern? Diese Frage hat die nahezu dreißigjährige Lehrtätigkeit der Autoren ständig begleitet, die Lehrtätigkeit sowohl im Bereich von Industrie und Hochschule als auch bei Schülern und Schülerinnen der Sekundarstufe unserer öffentlichen Schulen.
Die Buchreihe wendet sich an alle, die von makroskopischen Kenntnissen vieler Substanzen herkommend in die moderne mikroskopische Chemie einsteigen oder aus anderen Fächern „quereinsteigen“ wollen: Ein Quereinstieg ist deshalb in einen beliebigen Band der Buchreihe möglich, weil die Struktur der dort behandelten Stoffe nachgebaut und deshalb „begriffen“ werden kann. Das Konzept ist zunächst für Studenten und Studentinnen der technischen Berufe entwickelt worden: für Maschinenbauer, Versorgungsingenieure, Feinwerktechniker, Bauingenieure, Elektrotechniker. Es soll aber auch den interessierten Schüler oder die motivierte Schülerin ansprechen und jeden, der sich im Nebenfach für Chemie interessiert. Weiterhin hoffen wir, daß viele Chemielehrer, die den Lehrerfolg ihres Faches optimieren wollen, nützliche Anregungen aus der Buchreihe entnehmen können.

Im ersten Band wird das Periodensystem als „Teilchenbaukasten“ mit den dazugehörenden allgemeinen Kombinationsregeln vorgestellt. Die speziellen Teilchenkombinationen zu Metallkristallen, zu Molekülkristallen und Ionenkristallen finden sich in den weiteren Bänden.
Wenn die Strukturen wichtiger Stoffgruppen in einem ersten Abschnitt studiert worden sind, soll in einem zweiten Abschnitt die chemische Reaktion als Umgruppierung von Strukturen interpretiert werden. Sind die an der Reaktion beteiligten Strukturen aus dem ersten Abschnitt bekannt, wird auch ein Quereinstieg in die Welt der chemischen Reaktionen möglich. (Aus dem Vorwort)
Alle 6 Bände von „Chemie für Quereinsteiger“ gibt es zum kostenlosen Download bei WikiChemie.de.
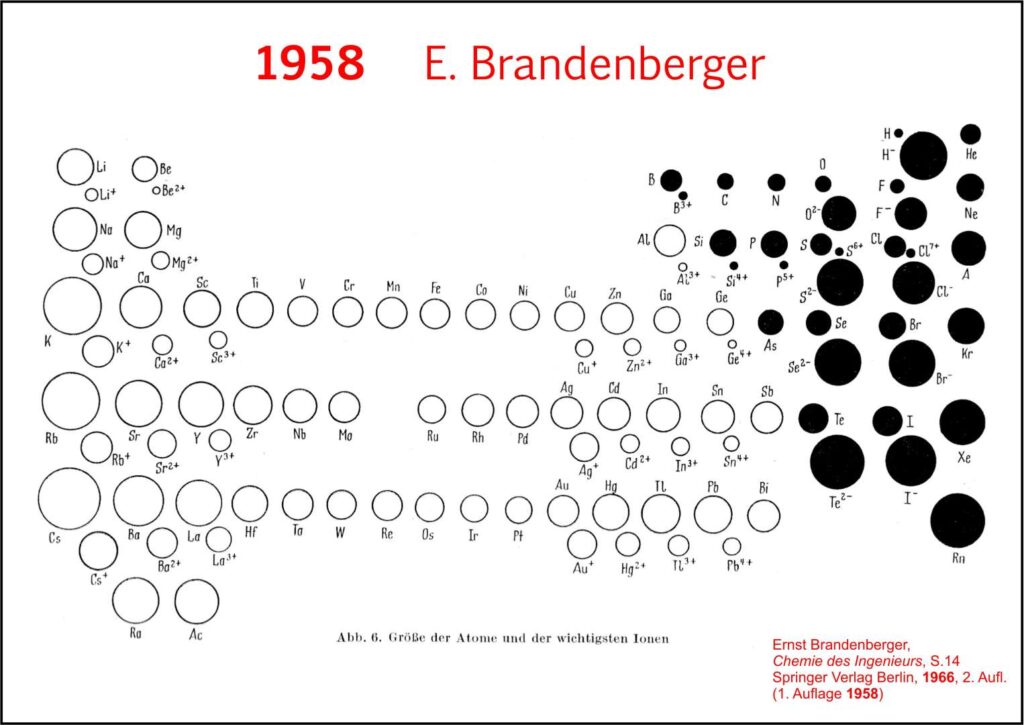
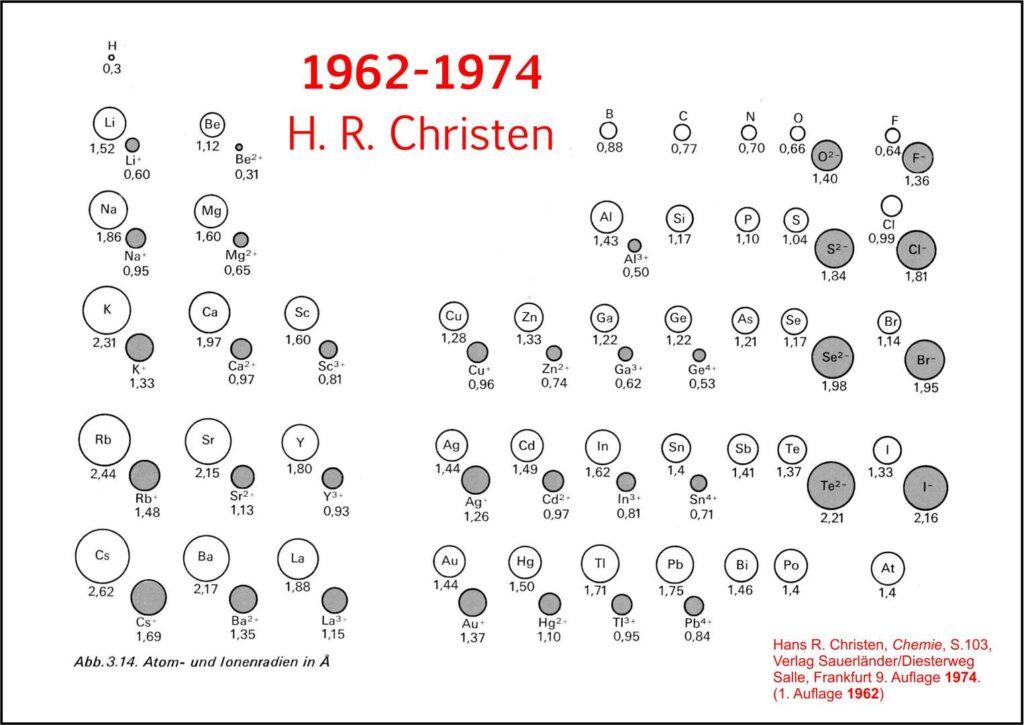
7. Entwicklung des didaktischen PSE
Die Entwicklung des didaktischen Periodensystems seit 1958 bis heute.