4. Konzept
Das PSE als Teilchenbaukasten
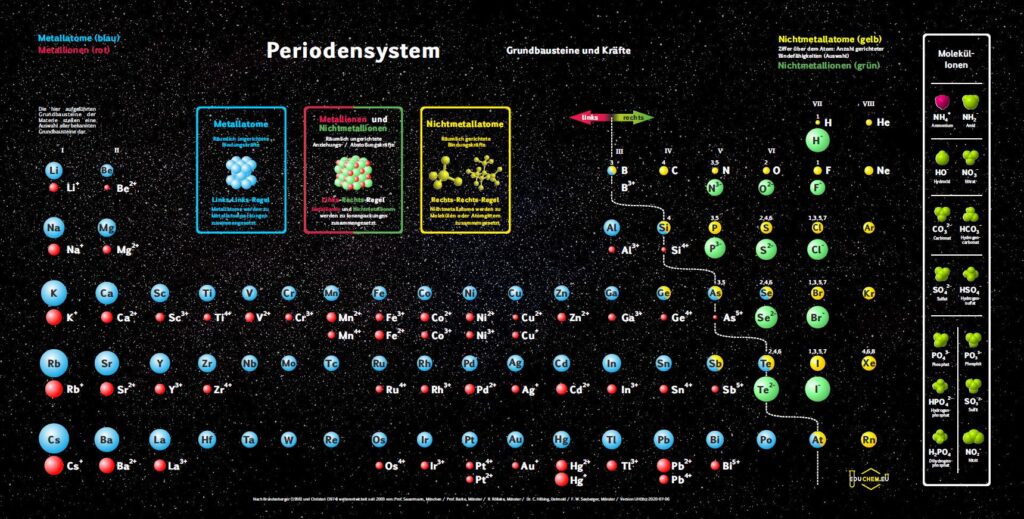
4.1. Grundbausteine
Untersucht man viele Substanzen experimentell bezüglich ihrer Bausteine, dann erhält man zwei, in ihren Qualitäten unterschiedliche Arten kleinster Teilchen. Ein großer Teil der Teilchen reagiert im elektrischen Feld, sie besitzen elektrische Ladung. Sie werden als Ionen bezeichnet. Andere Teilchen reagieren im elektrischen Feld nicht,
sie sind elektrisch ungeladen und heißen Atome. Die Teilchen werden als kugelförmige Grundbausteine dargestellt.
4.2. Kräfte
Viele Atome besitzen Kraftwirkungen untereinander, z. B. ziehen sich Eisenatome gegenseitig so stark an, dass Eisen zu den harten Substanzen gehört. Ionen üben andersartige Kraftwirkungen aufeinander aus, es gibt Anziehungs- und Abstoßungskräfte zwischen Ionen.
Dazu mehr in Barke, Sauermann, Chemie für Quereinsteiger – Band 1, Seite 26, http://www.wikichemie.de/web/band1_3.php
Aufgrund einer experimentellen Prüfung der Kraftqualitäten von Teilchen empfiehlt sich eine Einteilung in drei Klassen:
- Metall-Atome
- Nichtmetall-Atome
- Ionen
Die Einteilung erfolgt also aufgrund der Kraftqualität gegenüber anderen Teilchen. Dies ist die Grundlage unseres Unterrichtskonzepts.
4.3. Kombination der Grundbausteine
Alle Substanzen werden als – wie aus Legosteinen – zusammen gesetzte Kombinationen unzählig vieler Atome oder Ionen zu einem Teilchenverband beschrieben. Für das Konzept soll gelten: Es lassen sich sich nur Teilchen mit gleicher Kraftqualität zu Substanzen zusammen setzen. Die Verknüpfung von Teilchen erfolgt nach drei Regeln:
- Wenn wir im linken Teil des Periodensystems Teilchen miteinander verbinden wollen, dann müssen wir die Atome wählen und räumlich ungerichtet verknüpfen.
- Bei Teilchen aus dem rechten Teil wählen wir die Atome und verknüpfen sie räumlich gerichtet.
- Die Kombination von Teilchen der linken Seite mit Teilchen der rechten Seite verlangt, die entsprechenden Ionen räumlich ungerichtet zu verknüpfen.
Mehr dazu in Barke, Sauermann, Chemie für Quereinsteiger – Band 1, Seite 50. http://www.wikichemie.de/web/band1_4.php
Das PSE als Kombinationsbaukasten
Eine Erklärung des Periodensystems finden Sie in Barke, Sauermann, Chemie für Quereinsteiger – Band 1, Seite 22. http://www.wikichemie.de/web/band1_2.php
Weitere Hinweise
Die Anordnung des klassischen elektronentheoretisch begründeten Periodensystems wird von uns übernommen. Die Kräfte und Kombinationsregeln wurden eingetragen. Es liegt den Klassen im Unterricht sowie in allen Tests und Klausuren vor. Es werden
gute Lernerfolge erzielt im Verständnis von Strukturen und im Aufstellen und Erklären von Formeln und Gleichungen sowie bei der Symbolisierung von chemisch gedachten Strukturen und deren Veränderungen.
Anmerkung zur Stellung des Wasserstoffs
Die 7. Hauptgruppe beginnt mit dem Element Wasserstoff. Andere Darstellungen ordnen ihn in der 1. Hauptgruppe ein. Er wird hinsichtlich des Grundbaustein-Konzeptes wegen folgender Familienähnlichkeiten hier eingeordnet:
- Er bildet als Grundbaustein für Substanzen das H-Anion, das Kation (Proton) kann dagegen kein Gitterbaustein sein.
- Seine Ionenpackungen werden analog zu denen der Halogene gebildet, indem das negative H-Ion für links-rechts-Kombinationen den Gitterbaustein darstellt.
- Er ist wie die Halogene ein Nichtmetall und bildet viele zu den Halogenen analoge Nichtmetallverbindungen (rechts-rechts-Kombination).
Dies ist eine chemisch und didaktisch begründete Entscheidung. Sie geht von dem Ziel aus, die Grundbausteine zu repräsentieren und ein System vorzustellen, mit dem Verknüpfungen von Grundbausteinen richtig erstellt werden können. Dabei ist es absolut notwendig, dass der Wasserstoff so positioniert wird, weil sich das System sonst selbst
widerspricht. Die Einordnung des Wasserstoffs bei den Alkalimetallen soll weder bekämpft noch kritisiert werden – denn sie ist nicht besser oder schlechter, sondern sie ist ebenfalls eine zweckgebundene sachliche und didaktische Entscheidung – wie die unsere auch. Viel Erfolg mit beiden Systemen im Unterricht!
Text: Reinhard Rölleke, 2010
früher auf chemisch-denken.de
- Aktuelles PSE
- mit Molekülionen
- ohne Molekülionen
- Kurz-PSE
- Fünfbindiger Stickstoff vs. Oktettregel?
- Schreibweisen im Kräftemodell und Elektronenmodell
- PSE ohne „5 über N“ mit Molekülionen
- PSE ohne „5 über N“ ohne Molekülionen
- Anmerkungen
- Atomradien
- Konzept
- Begleitmaterial
- Entscheidungsschema
- Literatur
- Chemie für Quereinsteiger
- Historie PSE Didaktik
